5a. Základy termodynamiky a statistické fyziky - termodynamika
Obsah
Sylabus[editovat | editovat zdroj]
5. Základy termodynamiky a statistické fyziky
Teplota, teplo, tepelná kapacita. Termodynamické potenciály. Hlavní věty termodynamiky. Ideální plyn. Stavová rovnice, Carnotův cyklus.
Základy termodynamiky a statistické fyziky[editovat | editovat zdroj]
Termodynamika je fenomenologická věda, která se zabývá studiem nejobecnější rovnováhy makroskopických systémů, zejména v souvislosti s přenosem tepla a s teplotou.
Mezi základní termodynamické pojmy patří pojem systému - daného předmětu zkoumání. Obyčejně požadujeme, aby byl makroskopický (a popsatelný klasickou fyzikou) a aby byly přesně definovány jeho hranice a tím pádem i okolí.
Stav systému pak popisujeme souhrnem nezávislých makroskopických parametrů. Stav může být statický, obvykle zvaný rovnovážný, charakterizovaný nepřítomnosti toků fyzikálních veličin s jejich časovou neměnností, potom stacionární, kde připouštíme toky, a nestacionární, kde připouštíme i situace, kdy systém v některých okamžicích nemůžeme popsat obvyklými makroskopickými parametry vůbec.
Posloupnost stavů systému pak nazýváme termodynamický děj. Posloupnost statických stavů nazýváme kvazistatický děj, stacionárních kvazistacionární děj a nestacionárních nestacionární děj.
Parametry popisující systém mohou být extenzivní (aditivní: objem, energie) nebo intenzivní (v rovnováze se vyrovnají: tlak, teplota).
Rovnovážný stav soustavy je charakterizován nepřítomností toků a časovou neměnností fyzikálních veličin (vnitřních parametrů). Termodynamika je založena na dvou postulátech. První postulát termodynamiky nám říká, že libovolný izolovaný systém po uplynutí určité doby dospěje do rovnovážného stavu, který není nikdy spontánně narušen. Podle druhého postulátu termodynamiky pak je stav systému v rovnováze jednoznačně určen souborem všech vnějších parametrů a jediným parametrem vnitřním.
Teplota, teplo a tepelná kapacita[editovat | editovat zdroj]
Teplota je stavová intenzivní veličina určující stav systému. Rozlišujeme mezi dvěma teplotami:
Empirická teplota: Měříme ji teploměrem a její stupnici vyjadřujeme ve stupních. Stupnice této teploty je definovaná nějakými referenčními body, např. táním ledu a vřením vody. Tato definice je platnou definicí teploty, jelikož platí nultý termodynamický zákon.
Absolutní teplota: Předpokládáme-li platnost druhého postulátu termodynamiky,spolu s prvním a nultým, samozřejmě) můžeme odvodit, že totální diferenciál entropie je rovný diferenciálu tepla s integračním faktorem závislým pouze na empirické teplotě, je to tedy jisté přeškálování empirické teploty. Této funkci říkáme absolutní teplota.
Teplo je forma energie. Existují pouze dva možné způsoby přenosu energie, jedním je práce, druhým teplo, které může samovolně přecházet jenom z teplejšího tělesa na chladnější. Teplo můžeme definovat jako souhrn mikroskopických procesů mezi systémem a okolím. Práce popisuje uspořádaný, vratný proces, zatímco teplo je popisem procesu chaotického.
Poměr mezi přírůstkem tepla a přírůstkem teploty nazýváme tepelnou kapacitou:
- $ C_{proces}= \left( \frac{{\rm d}Q}{{\rm d}T} \right)_{proces} = T \left( \frac{{\rm d}S}{{\rm d}T} \right)_{proces}. $
Udává nám, kolik tepla je potřeba k zahřátí tělesa o $ \rm 1\, K $. Obecně závisí na podmínkách, za nichž k předání tepla došlo. Rovněž můžeme zavést i měrnou tepelnou kapacitu (na jednotku hmotnosti nebo na $ \rm 1\, mol $).
Pro ideální plyn platí vztahy:
- $ c_V = \left( \frac {\partial U} {\partial T} \right)_V , $
- $ c_p = \left( \frac {\partial U} {\partial T} \right)_V +\left( p+\left( \frac {\partial U} {\partial V} \right)_T \right) \left( \frac {\partial V} {\partial T} \right)_P , $
- $ c_p - c_V =R \, , $
- $ \frac{c_p}{c_V} =\kappa \, . $
Pro Van der Waalsův:
- $ c_P - c_V =\frac{R}{1- \frac{2a}{RTV}} \, , $
kde $ a $ je z van der Waalsovy stavové rovnice $ \left(p+\frac{a}{v^2}\right)\left(v-b\right)=RT $.
Metody měření základních termodynamických veličin[editovat | editovat zdroj]
K měření teploty používáme teploměry. Nejběžnějšími typy teploměrů jsou:
- kapalinové teploměry - pracují na základě objemové roztažnosti kapalin, nejznámější je rtuťový teploměr (lineární závislost roztažnosti na teplotě; dřív se používaly jako lékařské teploměry, ale dnes se v EU nesmí prodávat) a lihový teploměr (závislost na teplotě není lineární)
- plynové teploměry - pracují na základě objemové roztažnosti plynů při konstantním tlaku nebo využívají závislosti změny tlaku na teplotě při konstantním objemu
- bimetalové teploměry - založené na různé teplotní roztažnosti dvou různých kovů, z nich složený pásek se při změně teploty deformuje
- odporové teploměry - založen na teplotní závislosti elektrického odporu
- termočlánky - založené na termoelektrickém jevu: pokud svaříme dva různé vodiče a spoje uvedeme na různou teplotu, vznikne mezi nimi napětí úměrné teplotnímu rozdílu
K měření tepelné kapacity slouží kalorimetry - izolované nádoby, ve kterých dodáme zkoumané látce známé množství tepla a ze změny teploty určíme její tepelnou kapacitu. Kalorimetry mohou být:
- směšovací kalorimetr - zkoumané látce je dodáváno nebo odebíráno teplo jinou látkou známé tepelné kapacity
- elektrický kalorimetr - teplo je dodáváno z odporové spirály, můžeme ho určit z protékajícího proudu, napětí a doby
Termodynamické zákony[editovat | editovat zdroj]
Nultý termodynamický zákon[editovat | editovat zdroj]
Jedná se v podstatě o tranzitivitu termodynamické rovnováhy. Tedy přesně: Je-li systém A v termodynamické rovnováze se systémem B, a systém B v termodynamické rovnováze se systémem C, je také systém A v termodynamické rovnováze se systémem C.
První termodynamický zákon[editovat | editovat zdroj]
Znění: Vnitřní energie soustavy se může zvýšit dodaným teplem a snížit prací, jež soustava vykonala.
- $ {\rm d}U = {\rm d}Q - {\rm d}W $
Obecněji: Vnitřní energie soustavy se může zvýšit teplem nebo přidáním dalších částic a snížit prací, jež soustava vykonala.
- $ {\rm d}U={\rm d}Q-{\rm d}W+{\rm d}U_N $, kde $ {\rm d}U_N = {\mu}\, {\rm d}N $.
Kde $ {\rm d}U $ je úplný diferenciál: vnitřní energie charakterizuje stav (množství vnitřní energie nezávisí na způsobu přechodu). Naopak $ {\rm d}Q $ a $ {\rm d}W $ nejsou úplné diferenciály: teplo a práce charakterizují děj a ne stav. První termodynamický zákon vyjadřuje zákon zachování energie (vznik nebo zánik energie není možný).
Dle 1. VT nelze sestrojit tzv. perpetuum mobile prvního druhu, které by vykonávalo kladnou práci, aniž se mění energie tohoto zařízení nebo energie jeho okolí.
Druhý termodynamický zákon[editovat | editovat zdroj]
Zavádí další stavovou funkci, entropii = S. Všechny přírodní procesy jsou spojené s růstem celkové entropie (soustavy i vesmíru dohromady), všechny adiabatické vratné procesy jsou spojené s její nulovou změnou. Při obecném vratném procesu může entropie soustavy klesat i růst. Nulová změna entropie systému je, pokud se systém v průběhu děje navrátí do výchozího stavu.
Existuje více formulací 2.VT:
- Clausius: Je nemožné přenášet cyklickým procesem teplo z chladnějšího tělesa na teplejší, aniž se přitom dodá jisté množství práce.
- Kelvin + Thompson: Je nemožné cyklickým procesem odjímat jednomu tělesu (tepelná lázeň, termostat) teplo a měnit ji v kladnou práci, aniž přitom přejde jisté množství tepla z tělesa teplejšího na chladnější.
- Thompson: Je nemožné trvale vykonávat kladnou práci pouze tím, že bychom ochlazovali jedno těleso na teplotu nižší, než je teplota nejchladnější části jeho okolí.
- Planck: Je nemožné sestrojit periodicky pracující stroj (=perpetuum mobile druhého druhu), který by trvale vykonával kladnou mechanickou práci pouze ochlazováním jednoho tělesa, aniž při tom dochází k jiným změnám v ostatních tělesech.
- Carathéodory: V každém libovolném okolí libovolně daného počátečního stavu termicky homogenního systému existují stavy, k nimž se není možno libovolně přiblížit adiabatickou změnou stavových parametrů.
Pro vratné děje lze k $ {\rm d}Q $ najít integrační faktor tak, aby vzniklý výraz byl totálním diferenciálem. Tato veličina se nazývá entropie a integrační faktor obsahuje termodynamickou teplotu
- $ {\rm d}S=\frac{{\rm d}Q}{T} \, . $
Toto může být považováno za formulaci druhé termodynamické věty pro vratný děj.
Entropie charakterizuje míru neuspořádanosti systému. Umožňuje matematicky formulovat 2.VT, a tak kvantitativně vyjádřit podmínku pro nevratné procesy, které mohou bez zásahu probíhat v termodynamické soustavě jen v jednom směru (posloupnost těchto dějů dána navýšením entropie - s časem roste, definujeme "šipku času"). V izolovaných soustavách probíhají jen vratké procesy, při nichž entropie roste. Přestane růst, pokud izolovaná soustava dosáhne rovnovážného stavu, který se vyznačuje maximální hodnotou entropie za daných podmínek.
Pokud spojíme první a druhou větu termodynamiky, dostaneme:
- $ {\rm d}U \leq T\,{\rm d}S-{\rm d}W \, . $
Rovnost platí pro vratné děje.
Třetí termodynamický zákon[editovat | editovat zdroj]
Znění:
Znovu jich existuje více. Klasicky se uvádí Nernstovo z roku 1906, taky známé jako Nernstův postulát:
Změna entropie chemicky čistých látek při všech izotermických procesech se snižováním teploty zmenšuje závislost na stavových proměnných. V limitě absolutní nuly se pak entropie stává univerzální konstantou nezávislou na chemickém složení látek, kterou lze položit rovnou nule.
Nebo Planckovo:
Izoterma každé chemicky čisté látky při nulové teplotě splývá s vratnou adiabatou.
A tohle je ekvivalentní s tvrzením:
Posloupností konečně mnoho kroků není možné dosáhnout u chemicky čisté látky absolutní nulu.
Nernstův postulát se také dá formulovat matematicky:
- $ \lim_{T \rightarrow 0}\left(\frac{\partial S(T,X)}{\partial X} \right)_{T} = 0\,\forall X\text{vnější proměnné} $
Základní termodynamické procesy[editovat | editovat zdroj]
Izotermický: $ T = konst. \,\, \Rightarrow \,\, {\rm d}T = 0 $ Pro ideální plyn, kde je vnitřní energie pouze funkcí teploty, dostaneme $ dU = 0 \,\, \Rightarrow \,\, {\rm d}Q = {\rm d}W = p\,{\rm d}V $, v ideálním plynu Boyle-Mariottův zákon: $ pV = konst. $
Izochorický: $ V = konst \,\, \Rightarrow \, {\rm d}V = 0 $. Nekoná se práce, 1. věta termodynamická bude mít tvar $ {\rm d}Q = {\rm d}U $.
Izobarický: $ p = konst. \,\, \Rightarrow \,\, {\rm d}p = 0 $.
Adiabatický: $ S = konst. \,\, \Rightarrow \,\, {\rm d}Q = 0 \,\, \Rightarrow \,\, {\rm d}U = {\rm d}W $, tedy u ideálního plynu $ pV^\kappa = konst. $, kde $ \kappa $ je Poissonova konstanta $ \kappa = \frac{C_p}{C_v} = \frac{c_p}{c_v} $.
Polytropický: $ C_L = konst. $, tedy u ideálního plynu $ pV^\gamma = konst. $, kde $ \gamma $ je nějaká konstanta s hodnotou mezi $ 1 $ a $ \kappa $.
Termodynamické potenciály[editovat | editovat zdroj]
V základní termodynamické relaci:
- $ {\rm d}U \left( S,V \right) = T\left(S,V\right)\,{\rm d}S - p\left(S,V\right)\,{\rm d}V $
se objevuje pět stavových veličin: $ U, S, V, T $ a $ p $. Při stavu rovnováhy jsou pouze dvě z uvedených stavových veličin nezávislé, jejich číselná hodnota určuje stav termodynamického systému. Číselná hodnota ostatních stavových veličin je pak dána relacemi mezi nimi.
Libovolná funkce stavových proměnných je opět stavová veličina. Nové stavové veličiny jsou účelné, pokud: přirozeným způsobem vystihují podmínky určité třídy experimentů, významným způsobem zjednoduší termodynamické úvahy, mají snadno kontrolovatelné extremální vlastnosti a mají přímou souvislost s mikroskopickým popisem termodynamického systému.
Termodynamickými potenciály nazýváme 4 stavové veličiny, jimiž jsou: vnitřní energie $ U $, volná energie $ F $, entalpie $ H $ a Gibbsův potenciál $ G $.
Vnitřní energie[editovat | editovat zdroj]
Práce vykonaná termodynamickým systémem v průběhu adiabatického přechodu mezi dvěma rovnovážnými stavy je určena právě jen výchozím rovnovážným stavem a koncovým rovnovážným stavem.Vykonaná práce je pak rovna úbytku vnitřní energie.
Vnitřní energie je stavová veličina, jejíž úbytek v průběhu adiabatického procesu je roven práci, vykonané termodynamickým systémem na okolí:
- $ W_{adia}\left(D_1 \rightarrow D_2\right)=U_1 - U_2 \, . $
Přitom úbytek vnitřní energie určuje vykonanou práci nezávisle na tom, zda je uvažovaný adiabatický děj vratný nebo nevratný.
Vztahy:
- $ {\rm d}U \left( S,V \right)=T\left(S,V\right)\,{\rm d}S-p\left(S,V\right)\,{\rm d}V \, , $
- $ T(S,V)= \frac{ \partial }{\partial S} \left(S,V \right) \, , $
- $ P(S,V)=- \frac{\partial }{\partial V} \left(S,V \right) \, . $
Znalost funkcionální závislosti vnitřní energie na proměnných $ S $ a $ V $ pro daný termodynamický systém představuje úplnou termodynamickou informaci pro tento systém. Funkci $ U\left(S, V\right) $ můžeme nazvat mistrovskou funkcí a stavové veličiny $ S $ a $ V $ budeme nazývat přirozenými proměnnými pro vnitřní energii.
Termodynamické koeficienty[editovat | editovat zdroj]
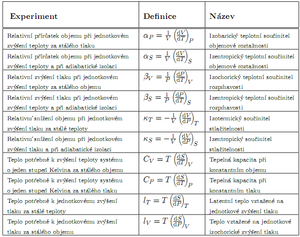
Termodynamickými koeficienty nazýváme speciální třídu úplných derivací typu $ \left( \frac{dA}{dB} \right)_C $, kde $ {A, B, C} $ je libovolná permutace, sestavená z prvků množiny $ \left\lbrace S, V, T, p \right\rbrace $. Z těchto dvanácti termodynamických koeficientů jsou nejvýše tři nezávislé.
Z důvodu snadné měřitelnosti se nejčastěji používají: izotermický součinitel stlačitelnosti $ \kappa_T = - \frac{1}{V} \left(\frac{{\rm d}V}{{\rm d}p}\right)_T $ (někdy nazývaný izotermická kompresibilita), izobarický teplotní součinitel objemové roztažnosti $ \alpha_p = \frac{1}{V} \left(\frac{{\rm d}V}{{\rm d}T}\right)_p $, a tepelná kapacita při konstantním tlaku $ C_p = T \left( \frac{{\rm d}S}{{\rm d}T}\right)_p $.
Volná energie[editovat | editovat zdroj]
V průběhu obecného (vratného i nevratného) izotermického děje představuje úbytek volné energie horní hranici pro možnou vykonanou práci:
- $ W_{izot}\left(D_1 \rightarrow D_2\right) \leq F\left(T_R, V_1\right) - F\left(T_R, V_2\right) $, kde $ T_R $ je teplota rezervoáru.
Hranice je dosaženo tehdy a jen tehdy, je-li izotermický děj vratný.
Při vratných izotermických procesech má volná energie analogický význam jako vnitřní energie při adiabatických procesech.
Vztahy:
- $ F \left( T,V \right) = U-TS(T,V)\, , $
- $ {\rm d}F \left( T,V \right)=-S\left( T,V \right)\,{\rm d}T-p\left( T,V \right)\,{\rm d}V\, , $
- $ S\left( T,V \right) =- \frac{\partial}{\partial T} F\left( T,V \right)\, , $
- $ p\left( T,V \right) =- \frac{\partial}{\partial V} F\left( T,V \right)\, . $
Znalost explicitní funkcionální závislosti volné energie na proměnných $ T $ a $ V $ pro daný termodynamický systém představuje úplnou a neredundantní termodynamickou informaci pro tento systém.
Entalpie[editovat | editovat zdroj]
Nebo také tepelná funkce a tepelný obsah je stavová veličina, jejíž diferenciál představuje při izobarickém procesu množství tepla $ {\rm d}Q $.
Vztahy:
- $ H \left( S,p \right) = U+pV\left( S,p \right) , $
- $ {\rm d}H \left( S,p \right)=T\, {\rm d}S+V\left( S,p \right)\,{\rm d}p \, , $
- $ T\left( S,p \right)= \frac{ \partial }{\partial S} H\left( S,p \right) , $
- $ V(S,p)= \frac{ \partial }{ \partial p} H\left( S,p \right) . $
Gibbsův potenciál[editovat | editovat zdroj]
Změna Gibbsova potenciálu představuje energii systému, která se spotřebuje na práci proti vnějším silám (kromě tlaku). Tato energie se kompenzuje teplem tak, že teplota a tlak systému zůstávají konstantní.
Vztahy:
- $ G \left( T,p \right) = H-TS = U+pV-TS = F+pV \, , $
- $ {\rm d}G \left( T,p \right)=-S\left( T,p \right)\,{\rm d}T+V\left( T,p \right)\,{\rm d}p \, , $
- $ S\left( T,p \right)=- \frac{ \partial }{ \partial T} G\left( T,p \right) \, , $
- $ V\left( T,p \right)= \frac{ \partial }{ \partial p} G\left( T,p \right) \, . $
Chemický potenciál[editovat | editovat zdroj]
Chemický potenciál termodynamického systému určitého druhu částic představuje změnu energie v systému při přidání jedné částice za předpokladu, že objem systému a jeho entropie se nezmění.
- $ \mu=\left( \frac{ \partial U }{ \partial n} \right)_{S,V} \, . $
Určuje změnu energie při vlastních chemických reakcích a při fázových přechodech, disociačních a ionizačních procesech, atd. Je to intenzivní veličina, může záviset na koncentraci, ale ne na celkovém počtu molů jednotlivých látek.
Pro ostatní termodynamické potenciály v systémech s proměnným počtem částic tedy platí:
- $ U=TS-pV-n\mu \, , $
- $ F=-pV+n\mu\, , $
- $ H=TS+n\mu\, . $
Dále platí: $ \mu=\left( \frac{ \partial U }{ \partial n} \right)_{S,V} = \left( \frac{ \partial F }{ \partial n} \right)_{T,V}=\left( \frac{ \partial H }{ \partial n} \right)_{S,p}=\left( \frac{ \partial G }{ \partial n} \right)_{T,p} $
Stavová rovnice, ideální plyn a reálné plyny[editovat | editovat zdroj]
Parametry popisující rovnovážný stav na sobě nejsou nezávislé, ale jsou svázány vztahy, které nazýváme stavová rovnice. Rovnici, která stanovuje vnitřní energii systému, nazýváme kalorickou $ U=U(a_i,T) $, např. $ U=U(T,V) $,rovnice spojující ostatní veličiny jsou rovnicemi termickými $ A_j = A_j(a_i,T) $, např. $ p=p(T,V) $. V těchto vztazích a označuje vnější parametry, a A vnitřní. Stavovou rovnici nemůžeme v rámci termodynamiky odvodit.
Kalorická a termická stavová rovnice na sobě nejsou nezávislé, ale jsou svázány rovnicí "devadesáti procent":
- $ T \left( \frac{ \partial A }{ \partial T } \right)_a = \left( \frac{ \partial U }{ \partial a } \right)_T + A(a,T), $
V termodynamice často studovaným systémem je ideální plyn. U ideálního plynu předpokládáme, že nemá vnitřní tření a je dokonale stlačitelný; přesně se řídí Boyle-Mariottovým zákonem (pV je konstanta) a Gay-Lussacovým zákonem (při izobarickém ději v id. plynu konstantní hmotnosti je objem plynu V přímo úměrný jeho termodynamické teplotě); rozměry molekul v id. plynu jsou zanedbatelně malé ve srovnání se střední vzdáleností molekul od sebe + molekuly id. plynu na sebe kromě vzájemných srážek nepůsobí + vzájemné srážky molekul id. plynu a srážky těchto molekul se stěnami jsou dokonale pružné. Většinu plynů lze za běžných podmínek považovat za ideální.
Termická stavová rovnice pro ideální plyn má tvar:
- $ p= \frac{nRT}{V} = \frac{nN_akT}{V}. $
Kalorická stavová rovnice pro ideální plyn má tvar:
- $ U=n \left( c_VT+U_0 \right). $
Jeden ze složitějších modelů popisujících plyn je model van der Waalsova plynu:
- $ \left( p+ \frac{n^2a}{V^2}\right) (V-nb) = nRT \, . $
V tomto modelu započítáváme jednak přitažlivé síly, kterými na sebe molekuly plynu působí, započtením vnitřního tlaku, který vzájemným působením vytvářejí, jednak odpudivé síly působící na blízké vzdálenosti zmenšením objemu, do kterého "jedna molekula ostatní pustí".
Dále lze napsat stavová rovnice pro záření absolutně černého tělesa:
- $ p= \frac{1}{3} \sigma T^4 \, , $
- $ U= \sigma VT^4 \, . $
Carnotův cyklus[editovat | editovat zdroj]
Carnotovým cyklem nazýváme vratný cyklický děj, který se skládá ze dvou adiabatických a dvou izotermických částí. Je to dobré schéma činnosti tepelných strojů. Nakreslíme-li si Carnotův cyklus v $ pV $ - diagramu, bude plocha, kterou křivky ohraničují, rovna získané práci.
U Carnotova cyklu můžeme snadno určit jeho účinnost (na adiabatách je $ {\rm d}Q = 0 $):
- $ \int_1 \frac{{\rm d}Q}{T_1} + \int_2 \frac {{\rm d}Q}{T_2} = 0 \Rightarrow \frac{Q_1}{Q_2}= \frac{T_1}{T_2}. $
Účinnost:
- $ \eta = \frac{Q_2 - Q_1}{Q_2} = \frac{T_2 - T_1}{T_2}, $
tedy závisí pouze na teplotě chladiče $ T_1 $ a ohřívače $ T_2 $, nezávisí na způsobu, jakým byl Carnotův cyklus proveden ani na použité hmotě.
Fázové přechody[editovat | editovat zdroj]
Fázovými přechody nazýváme přechod látky z jednoho stavu do jiného, např. přechod z pevného do kapalného skupenství, ale i přechod mezi dvěma různými krystalickými formami, mezi feromagnetikem a paramagnetikem, přechod vodiče do supravodivého stavu, apod.
Stavová rovnice nám určuje rovnovážný stav systému. Pokud ji zakreslíme do prostorového grafu $ \left\lbrace A,a,T \right\rbrace $ a vyznačíme navíc, které fázi odpovídá jednotlivé části této plochy, dostaneme fázový diagram. Často se používá průmět fázového diagramu pouze do os $ \left\lbrace A,T \right\rbrace $. Tento diagram má dva význačné body - trojný bod, kdy mohou v rovnováze koexistovat všechny tři fáze, a kritický bod, kdy mizí rozdíl mezi plynem a kapalinou.
Vyšetřujeme-li obecný systém s proměnným počtem částic, musíme do vyjádření energie přidat výraz, který má charakter práce; je to v podstatě energie, kterou si "vzniklá" částice přinese:
- $ {\rm d}U = T\,{\rm d}S - A\,{\rm d}a + \mu \,{\rm d}n \, , $
kde $ \mu $ se nazývá chemický potenciál, $ {\rm d}n $ odpovídá změně počtu molů.
Chceme-li určit podmínku pro rovnováhu dvou fází, zjistíme, že se musí jednak rovnat tlaky ($ A $) a jednak chemické potenciály. Pokud je splněna podmínka rovnosti chemických potenciálů, dostaneme v $ pT $ - diagramu křivku $ p = p\left(T\right) $, která nám určuje křivku rovnováhy dvou fází.
Fázové přechody prvního a druhého druhu[editovat | editovat zdroj]
V přírodě se vyskytující fázové přechody můžeme rozdělit do dvou skupin.
V případě fázových přechodů prvního druhu se sice rovnají chemické potenciály, ale nerovnají se jejich derivace:
- $ \mu_A = \mu_B \, , $
ale
- $ \left( \frac{ \partial \mu_A}{ \partial T} \right)_p \neq \left( \frac{ \partial \mu_B}{ \partial T} \right)_p , $
nebo
- $ \left( \frac{ \partial \mu_A}{ \partial p} \right)_T \neq \left( \frac{ \partial \mu_B}{ \partial p} \right)_T . $
Tyto derivace odpovídají přenosu tepla, resp. změně molárního objemu. Při fázovém přechodu prvního druhu tedy látka mění svůj objem a k přechodu se spotřebuje teplo; jedná se o tzv. skupenské teplo fázových přechodů. Přenosem tohoto tepla nedojde ke změně teploty, ale pouze ke změně fáze. Mezi fázové přechody prvního druhu patří všechny skupenské přechody a většina přechodů mezi krystalickými fázemi.
Chceme-li charakterizovat fázové přechody prvního druhu, můžeme použít Clausiovu-Clapeyronovu rovnici:
- $ \frac{{\rm d}p}{{\rm d}T} = \frac{Q_{sk}}{T \Delta V_m} $
kde derivace $ \frac{{\rm d}p}{{\rm d}T} $ je myšlena podél křivky koexistence dvou fází. Z této rovnice pak můžeme odhadnout závislost $ p\left( T \right) $.
U fázových přechodů druhého druhu jsou spojité první derivace chemického potenciálu, ale skokově se mění druhé, což odpovídá skokové změně parametrů jako je molární tepelná kapacita, koeficient roztažnosti a stlačitelnosti. Mezi takovéto přechody patří změna mezi paramagnetikem a feromagnetikem v okolí Curieovy teploty nebo přechod kovů do supravodivého stavu. Vzhledem k tomu, že neexistuje skupenské teplo, neexistuje ani stav analogický přehřátí a podchlazení.
Poznámka: V praxi pozorujeme, že můžeme přehřát kapalinu nad bod varu, nebo naopak podchladit velmi čistou vodu pod bod tuhnutí. Jedná se o metastabilní stav; stačí malý podnět (úder nebo snítko) a látka přejde do stabilního stavu. Praktickou aplikací tohoto jevu je např. Wilsonova mlžná komora nebo bublinková komora.
Links[editovat | editovat zdroj]
- Magický termodynamický čtverec - popis a schéma zde