14a. Stavba atomů, molekul a kondenzovaných látek - atom
Stacionární stavy atomů a molekul, elektrické a magnetické momenty.
Obsah
Historické modely atómu[editovat | editovat zdroj]
Thomsonov model atómu[editovat | editovat zdroj]
Thomsonov model (tiež známy ako pudingový model) je založený na predstave atómu ako rovnomerne kladne nabitej gule, v ktorej sa nachádzajú elektróny. Pričom oba druhy náboja sú vyrovnané, tak aby celkový náboj atómu bol nula. Opis procesov v tomto modeli bol založený na klasických predstavách. V období vzniku Thomsonovho modelu bola známa jediná elementárna častica a to elektrón (objavený Thomsonom v roku 1897). Samotné elektróny sa mohli v rámci modelu pohybovat, mohli tak vytvárať rôzne štruktúry. Predpokladal sa pohyb elektrónov po určitých orbitách stabilizovaných jednak príťažlivou silou kladne nabitého oblaku a jednak interakciou s ostatnými elektrónmi. Thomson sa taktiež v rámci tohto modelu snažil vysvetliť experimentálne objavené spektrálne čiary, čo sa mu však nepodarilo. Tento model bol nahradený planetárnym modelom atómu a to v súvislosti s výsledkami rozptylu alfa častíc na jadrách zlata (rok 1909).
Planetárny model[editovat | editovat zdroj]
Podstatou modelu je, že v strede jadra sa nachádza kladne nabité v porovnaní s rozmermi atómu malé jadro. Okolo jadra obiehajú elektróny po orbitálnych dráhach (podobne ako v planetárnom modely slnečnej sústavy). Model predpovedá priemer atomového jadra približne 10-15 metrov a priemer elektrónového obalu približne 10-10 m. Problémom celého modelu je skutočnosť, že elektrón by pri pohybe po zakrivenej dráhe vyžaroval energiu a postpne by padal na nižšiu orbitu, pričom celý tento proces by netrval dlhšie ako 10-16 sekúnd (Beiser str. 131) a atóm by bol jednoducho nestabilný. Tento model bol základným východiskom pri formulácii bohrovho modelu atómu.
Orbity elektrónov vo vodíku[editovat | editovat zdroj]
Jadro vodíka obsahuje jeden protón a atómový obal jeden elektrón. Budeme sa zaujímať o pohyb elektrónu po kruhovej dráhe. pri tomto pohybe sa odstredivá sila $ F_d $ vyrovná elektrostatickej sile $ F_e $ danej Coulombovým zákonom:
- $ m\frac{v^2}{r} = \frac{1}{4\pi\varepsilon_0}\frac{e^2}{r^2} $,
kde $ m $ je hmotnosť elektrónu, $ v $ je jeho rýchlosť a $ r $ je polomer kruhovej dráhy. Celková energia $ E $ elektrónu je súčtom kinetickej energie $ E_k $ a potenciálnej energie $ E_p $:, dostávame teda nasledujúce vzťahy:
- $ E = E_k+E_p = \frac{1}{2}mv^2 - \frac{1}{4\pi\varepsilon_0}\frac{e^2}{r} = \frac{e^2}{8\pi\varepsilon_0 r} - \frac{e^2}{4\pi\varepsilon_0 r} = -\frac{e^2}{8\pi\varepsilon_0 r} $
Energia nám vyšla záporná, teda elektrón je skutočne viazaný. Experimentom určená energia potrebná k oddeleniu elektrónu od protónu je 13,6 eV. Po dosadení tejto hodnoty do predchádzajúceho vzťahu dostaneme polomer dráhy elektrónu v atóme vodíka:
- $ r = -\frac{e^2}{8\pi\varepsilon_0 E} = 5,3\cdot 10^{-11}\,\mbox{m} $
Bohrov model[editovat | editovat zdroj]
Bohrov model atómu vychádza z planetárneho modelu atómu. Predpokladá záporne nabité elektróny obiehajúce po orbitách okolo kladne nabitého jadra. Problémy stability atómu rieši postulovaním istých "kvantových" pravidel.
Bohrové postuláty[editovat | editovat zdroj]
Bohrov model atómu je poloklasickou teóriou používajúcou okrem zákonov klasickej fyziky iba de Brogliho hypotézu duality vĺn a častíc a Einsteinov kvantovací vzťah. De Broglieho hypotéza o dualite častíc a vĺn priaraduje elektrónu s hmotnosťou $ m $ a rýcholsťou $ v $ tzv. de Brogliho vlnovú dĺžku $ \lambda = \frac{h}{mv} $. Einsteinov vzťah $ \, E = hf $ dáva do súvisu energiu fotónu s jeho frekvenciou $ f $, ktorá korešponduje s Brogliho vlnovou dĺžkou.
- 1. postulát
Elektrón s de Brogliho vlnovou dĺžkou $ \lambda $ môže obiehať len po kruhových orbitách splňujúcich nasledujúcu (kvantovaciu) podmienku:
- $ \, n\lambda = 2\pi r_n $,
- 2. postulát
Elektrón pri pohybe po orbite splňujúcej kvantovaciu podmienku samovoľne nemení svoj stav.
- 3. postulát
Elektrón má povolené iba prechody medzi orbitami splňujúcimi kvantovaciu podmienku. Pri týchto prechodoch však musí prijať alebo vyžiariť zodpovedajúcu energiu v podobe fotónu o frekvencii danej vzťahom:
- $ \nu = \frac{E_i-E_f}{h} $
Prípustné orbity elektrónu v atóme vodíku[editovat | editovat zdroj]
Bohrov model atómu popisuje orbitu obiehajúceho elektrónu v atóme vodíka plne klasicky. Stavba atómu vodíka zodpovedá planetárnemu modelu, teda záporne nabitý elektrón obieha okolo kladne nabitého protónu. V takomto prípade sa elektrón pohybuje po kruhovej dráhe iba vtedy, ak sa odstredivá sila $ F_d $ vyrovná elektrostatickej sile $ F_e $ danej Coulombovým zákonom:
- $ \, F_d = F_e $,
- $ m\frac{v^2}{r} = \frac{1}{4\pi\varepsilon_0}\frac{e^2}{r^2} $,
Z čoho bez problémov vyjadríme de Broglieho vlnovú dĺžku elektrónu $ \lambda $ ako:
- $ \lambda = \frac{h}{e}\sqrt{\frac{4\pi\varepsilon_0 r}{m}} $,
kde $ r $ je polomer kruhovej orbity elektrónu s hmotnosťou $ m $ a elektrickým nábojom $ e $. Až v tomto momente využijeme prvý bohrov postulát. Ten nehovorí nič iné, len že obvod kruhovej orbity je celočíselným násobkom de Broglieho vlnových dĺžok elektrónu pohybujúceho sa po takejto dráhe. Tento predpokladad by sme mohli interpretovať tak, že na drahách nezodpovídajúcích celočíselným násobkom vlnových dĺžok dochádza k rušivým interferenciám de Broglieho vln, ktoré preto zaniknú. Naopak v prípade celočíselných násobkov vlny na seba po ubehnutí jednej dráhy plynule naväzujú a preto nedochádza k interferencii.
Z Bohrovhoo prvého postulátu preto odvodíme nasledujúcu podmienku pre stabilnú dráhu elektrónu:
- $ \, 2\pi mr_n v_n = nh $,
kde $ v_n $ označuje rychlost elektronu při pohybu na dráze o poloměru $ r_n $.
Teraz už len dosadíme túto kvantovaciu podmienku do vzťahu pre de Brogliho vlnovú dĺžku elektrónu a upravíme tak aby sme dostali vyjadrenie pre polomer prípustných kruhových orbít $ r_n $:
- $ r_n = \frac{n^2h^2\varepsilon_0}{\pi me^2} $
Ako uvidíme nižšie elektrón nadobúda pre $ n=1 $ minimálnu energiu a polomer jeho orbity sa nazýva Bohrov polomer atómu vodíku. Označujeme ho $ a_0 $ a má hodnotu:
- $ a_0 = r_1 = 5,3\cdot 10^{-11} \mbox{m} $
Pri pohľade späť na výpočet teda zisťujeme, že prvý Bohrov postulát vyselektoval zo všetkých klasicky prípustných orbít (určených v rámci planetárneho modelu) iba určitý diskrétny počet prípustných realizovateľných dráh.
Energia elektrónu v atóme vodíku[editovat | editovat zdroj]
Celkovú energiu $ E $ elektrónu spočítame opäť "takmer" klasicky. V klasickej mechanike je celková energia súčtom kinetickej energie $ E_k $ a elektrostatickej potenciálnej energie $ E_p $:
- $ E = E_k+E_p = \frac{mv^2}{2} - \frac{1}{4\pi\varepsilon_0}\frac{e^2}{r} = \frac{e^2}{8\pi\varepsilon_0 r} - \frac{e^2}{4\pi\varepsilon_0 r} = -\frac{e^2}{8\pi\varepsilon_0 r} $.
V predošlom odstavci sme však ukázali, že polomery $ r $ nebudú v atóme vodíka ľubovoľné, práve naopak dostali sme veľmi jasné vyjadrenie pre prípustné polomery $ r_n $. Nezostáva nám už teda nič iné ako použiť tento vzťah a dostaneme výraz pre prípustné energie:
- $ E_n = -\frac{me^4}{8\varepsilon_0^2h^2}\left(\frac{1}{n^2}\right) $
Pričom $ n=1,2,3,... $. Energia elektrónu je opäť záporná (elektrón je viazaný) a navyše ešte je "kvantovaná" a to vďaka tom, že sú prípustné iba určité dráhy. Takto získané hodnoty energie sa označujú ako energetické hladiny vodíkového atomu. Najnižšiu energetickú hladinu $ E_1 $ dostávame pre $ n = 1 $ a hovoríme o základnom stave vodíku.
Po dosadení konkrétnych hodnôt dostaneme energiu základného stavu vodíku rovnú $ R=|E_1|=13,6 \mbox{eV} =2,17\cdot 10^{-18} \mbox{J} $, nazývanú aj Rydbergová konštanta. Vyššie hladiny, tzn. $ E_2, E_3, E_4 $ atď. označujeme ako excitované stavy.
Povolené prechody v atóme vodíku[editovat | editovat zdroj]
Prechod elektrónu medzi dvoma prípustnými dráhami s kvantovými číslami $ n_i $ a $ n_f $ je možný, je však vždy spojený so zmenov energie elektrónu a teda s vyžiarením prípadne pohltením fotónu. Frekvencia týchto fotónov sa riadi vzťahom:
- $ \nu = \frac{E_i-E_f}{h} = \frac{me^4}{8\varepsilon_0^2h^3}\left(\frac{1}{n_f^2}-\frac{1}{n_i^2}\right) $
kde $ E_i $ označuje energiu počiatočného stavu elektrónu a $ E_f $ označuje energiu konečného stavu.
Čiarové spektrum atómu vodíka[editovat | editovat zdroj]
Bohrov model s pomocou predošlého vzťahu predpovedá energie žiarenia vyvolaného prechodmi elektrónov v obale vodíka. Opäť je zrejmé, že nie su prípustné všetky možné energie ale iba určité diskrétne hodnoty. Táto predpoveď bola jedným s najdôležitejších výsledkov Bohrovho modelu atómu, pretože vysvetlila vtedy už experimentálne objavené ale nevysvetlené čiarové spektrá atómov. S pomocou uvedeného vzťahu teda dostávame tieto výrazy:
Lymanova séria spektrálnych čiar, ktorá zodpovedá prechodu elektrónu z excitovaného stavu do základného stavu:
- $ \frac{1}{\lambda} = \frac{me^4}{8\varepsilon_0^2ch^3}\left(\frac{1}{1^2} - \frac{1}{n^2}\right) $,
kde $ n=n_i=2,3,4,... $
Balmerova séria spektrálnych čiar, ktorá zodpovedá prechodu elektrónu z excitovaného stavu do stavu $ n_f=2 $:
- $ \frac{1}{\lambda} = \frac{me^4}{8\varepsilon_0^2ch^3}\left(\frac{1}{2^2}-\frac{1}{n^2}\right) $,
kde $ n=n_i=3,4,5,... $
Paschenova séria spektrálnych čiar, ktorá zodpovedá prechodu elektrónu z excitovaného stavu do stavu $ n_f=3 $:
- $ \frac{1}{\lambda} = \frac{me^4}{8\varepsilon_0^2ch^3}\left(\frac{1}{3^2}-\frac{1}{n^2}\right) $,
kde $ n=n_i=4,5,6,... $ Brackettova séria spektrálnych čiar, ktorá zodpovedá prechodu elektrónu z excitovaného stavu do stavu $ n_f=4 $:
- $ \frac{1}{\lambda} = \frac{me^4}{8\varepsilon_0^2ch^3}\left(\frac{1}{4^2}-\frac{1}{n^2}\right) $,
kde $ n=n_i=5,6,7,... $
Pfundova séria spektrálnych čiar, ktorá zodpovedá prechodu elektrónu z excitovaného stavu do stavu $ n_f=5 $:
- $ \frac{1}{\lambda} = \frac{me^4}{8\varepsilon_0^2ch^3}\left(\frac{1}{5^2}-\frac{1}{n^2}\right) $,
kde $ n=n_i=6,7,8,... $
V prípade "zachytenia" voľného elektrónu na protóne môžeme tento proces popísať ako prechod z excitovaného stavu $ n_i\to\infty $ do stavu $ n_f=n $. A vlnová dĺžka vyžiareného fotónu bude:
- $ \frac{1}{\lambda} = \frac{me^4}{8\varepsilon_0^2ch^3 n^2} $
Pre rôzne $ n $ je to zároveň tzv. hrana série, pretože zodpovedá maximálnej možnej energii zodpovedajúcej danej sérii.
Spektrálne čiary vznikajúce pri prechode z vyššieho stavu do nižšieho stavu sú sprevádzané vyžiarením (emisiou) fotónu, nazývajú sa emisnými čiarami. Prechod z nižšieho stavu do vyššieho stavu sú vyvolané pohltením (absorpciou) fotónu. Spektrálne čiary zodpovedajúce týmto prechodom sa nazývajú absorbčnými čiarami.
Nedostatky modelu[editovat | editovat zdroj]
Bohrov model atómu bol prvou fyzikálnou teóriou podávajúcou kvalitatívne vysvetlenie pre čiarové spektrá atómov. v prípade vodíku majú dokonca význam aj kvantitatívne závery z tohto modelu. Už v období vzniku Bohrovho modelu však existovali experimentálne poznatky odporujúce tejto teórii.
Bohrov model taktiež nepredstavuje koncepčne uzavretú teóriu, myslí sa tým hlavne "podivné" skombinovanie klasickej fyziky s niektorými kvantovými zákonitoťami. Takouto ucelenou teóriou sa nakoniec stala kvantová mechanika používana dnes pri popisoch atómov.
- Bohrové postuláty majú len jedno jediné opodstatnenie a to, že dokážu správne predpovedať niektoré pozorované skutočnosti.
- Nedokáže dať odpovede na problémy týkajúce sa chemických zlúčenín a nefunguje ani v prípade komplikovaných atómov (mnohoelektrónové atómy s viac ako jedným elektrónom vo valenčnej vrstve).
- Orbitálny moment hybnosti elektrónu v základnom stave je podľa Bohrovho modelu rovný $ \hbar $. V skutočnosti je rovný nule.
- Spektrálne čiary zrátané podľa tohto modelu sedia iba pre vodík.
- Bohrov model nedokáže vysvetliť štiepenie spektrálny čiar pod vplyvom magnetického poľa, tzv. Zeemanov jav.
- Klasické predstavy o orbirte elektrónu sú v priamom rozpore s princípmy kvantovej mechaniky.
Spin v kvantovej mechanike (stručne)[editovat | editovat zdroj]
Skôr ako prejdeme ku kvantovo mechanickému popisu atómu, je nutné sa aspoň stručne oboznámiť s pojmom spinu, pretože tento výrazne ovplyvňuje vlastnosti atómov (napríklad magnetické vlastnosti železa). Snahou tohto odseku nie je zachádzať do podrobností, skôr ma mať "uživateľský" charakter. Kto by mal pocit, že potrebuje o spine vedieť viac, tomu odporúčam Úvod do kvantovej mechaniky od Pišúta.
Vlastnosť častice "mať spin" je v kvantovej mechanike vyjadrená pomocou vhodných komutačných relácii, ktoré sa formálne podobajú na komutačné relácie orbitálneho momentu hybnosti. Z nich potom plynú nasledujúce vzťahy pre vlastné funkcie spinových stavov $ |s,m\rangle $:
- pôsobenie operátoru kvadrátu spinu: $ \, S^2 |s,m\rangle = \hbar^2 s(s + 1) |s,m\rangle $
- pôsobenie operátoru kvadrátu spinu: $ \, S^2 |s,m\rangle = \hbar^2 s(s + 1) |s,m\rangle $
- pôsobenie operátoru projekcie spinu do osi z: $ \, S_z |s,m\rangle = \hbar m |s,m\rangle $
- pôsobenie operátoru projekcie spinu do osi z: $ \, S_z |s,m\rangle = \hbar m |s,m\rangle $
Tieto vzťahy sú formálne zhodné so vzťahmi pre orbitálny moment hybnosti. Rozdiel však spočíva hlavne v tom, že s a m možu nadobúdať aj poločíselné hodnoty.
Spin s určitej častice je jej charakteristickou vlastnosťou a musí sa preto zachovávať. Tak napríklad elektrón ma spin s rovný 1/2 a existuje len s týmto spinom. Môže sa však nachádzať v dvoch stavoch s danou projekciou m. A to m = 1/2 alebo -1/2, pričom číslu m sa hovorí často aj spinové magnetické číslo (dôvod uvedený nižšie).
Taktiež treba dať pozor, že pojmy spin a projekcia spinu nie su v literatúre často striktne oddelené a že pod pojmom spin sa často myslí práve jeho projekcia na os z (či inú ľubovoľnú). Taktiež treba zdôrazniť, že číslu m sa častejšie hovorí spinové magnetické číslo.
Spin - vektor alebo spinor?[editovat | editovat zdroj]
V klasickej mechanike bol orbitálny moment vektorom, ktorého smer určoval os aj smer rotácie a ktorého veľkosť vyjadrovala rýchlosť danej rotácie. Situácia v kvantovej mechanike je však o čosi komplikovanejšia, pretože súčasne môžeme určiť iba veľkosť spinu a jeho priemet na nejakú os (operátory jednotlivých zložiek spinu navzájom nekomutujú, Davydov str. 172 alebo Pišút str. 348). V skutočnosti však spin v kvantovej mechanike predstavuje matematický objekt, ktorému sa hovorí spinor. Povedané v stručnosti rozdiel medzi vektorom a spinorom spočíva v rozdielnom transformovaní sa pri zmene súradnej sústavy (podrobnosti k transformácii spinu Davydov str. 181 alebo Pišút str. 348).
Jasne definovaná je veľkosť spinu. Tá pre časticu opísanú kvantovým číslom s je daná vzťahom:
- $ S = \hbar \, \sqrt{s (s+1)}, $
- $ S = \hbar \, \sqrt{s (s+1)}, $
Takáto častica môže mať 2s+1 rôznych projekcii spinu na danú os z (alebo inú ľubovoľnú):
- $ \hbar s_z, \qquad s_z = - s, - s + 1, \cdots, s - 1, s $
- $ \hbar s_z, \qquad s_z = - s, - s + 1, \cdots, s - 1, s $
Avšak aj v kvantovej mechanike existuje spôsob ako zaviesť spin ako vektor. Tento vektor sa volá spinový vektor a označujeme ho $ \lang S \rang $. Jeho komponenty budú strednými hodnotami meraní:
- $ \lang S \rang = [\lang s_x \rang, \lang s_y \rang, \lang s_z \rang] $
- $ \lang S \rang = [\lang s_x \rang, \lang s_y \rang, \lang s_z \rang] $
S takýmto vektorom sa pracuje hlavne v experimentálnej fyzike a na jeho zavedenie je nutné previesť rovnaký experiment mnohonásobne. Pretože jednotlivé projekcie spinu nemôžeme namerať súčasne (relácie neurčitosti to zakazujú) budeme nútený merať nasledovne: Experiment vykonáme napríklad 999 krát, 333 krát zmeráme projekciu spinu na os x , 333 krát na os y a v zvyšnej tretine prípadov budeme merať projekciu na os z.
V prípade, že máme dostatočný súbor častíc nachádzajúcich sa pôvodne v ostrých stavoch, napríklad pri Stern-Gerlachovom pokuse, má vektor $ \lang S \rang $ veľmi jednoznačnú interpretáciu:
Spin a Pauliho vylučovací princíp[editovat | editovat zdroj]
Predpokladajme, že máme dve identické častice, ktorých stavy opíšeme súborne pomocou indexov a a b. Ich celkový stav opíšeme pomocou funkcie $ \psi (a,b) $ . Obe častice sú identické a to znamená, že meraním nemožeme zistiť, ktorá z častíc sa nachádza v ktorom stave. Presnejšie máme dve možnosti: V stave a sa nachádza častica 1 a v stave b sa nachádza častica 2, čo stručne zapíšeme ako $ \psi (1,2) $. Druhou možnosťou je, že v stave a sa nachádza častica 2 a v stave b sa nachádza častica 1, čo stručne zapíšeme ako $ \psi (2,1) $. Ktorá z možností bola realizovaná však principiálne nemôžeme určiť a preto musí platiť:
- $ |\psi \, (1,2)|^2 = |\psi \, (2,1)|^2 $
- $ |\psi \, (1,2)|^2 = |\psi \, (2,1)|^2 $
Pričom rozlišujeme vlnové funkcie s týmito vlastnosťami:
- symetrická vlnová f.: $ \psi \, (1,2) = \psi \, (2,1) $
- antisymetrická vlnová f.: $ \psi \, (1,2) = -\psi \, (2,1) $
- symetrická vlnová f.: $ \psi \, (1,2) = \psi \, (2,1) $
Predpokladajme teraz navyše, že identické častice 1 a 2 navzájom neinteragujú, potom môžeme napísať celkovú vlnovú funkciu ako súčin jednotlivých stavov:
- $ \psi \, (1,2) = \psi_a (1) \psi_b (2) $
- $ \psi \, (1,2) = \psi_a (1) \psi_b (2) $
resp.
- $ \psi \, (2,1) = \psi_a (2) \psi_b (1) $
- $ \psi \, (2,1) = \psi_a (2) \psi_b (1) $
Opäť však nemôžeme určiť ktorá z predošlých možností bola realizovaná. Obecne môže byť celková vlnová funkcia dokonca ľubovoľnou lineárnou kombináciou predošlých dvoch stavov. Ak však budeme požadovať dalšie obmedzenie a to (anti)symetrické vlastnosti vlnovej funkcie, dostaneme len tieto stavy:
symetrická vlnová funcia:
- $ \psi_S = \frac{1}{\sqrt2}[ \psi_a (1) \psi_b (2) + \psi_a (2) \psi_b (1)] $
- $ \psi_S = \frac{1}{\sqrt2}[ \psi_a (1) \psi_b (2) + \psi_a (2) \psi_b (1)] $
antisymetrická vlnová funcia:
- $ \psi_A = \frac{1}{\sqrt2} [ \psi_a (1) \psi_b (2) - \psi_a (2) \psi_b (1) ] $
- $ \psi_A = \frac{1}{\sqrt2} [ \psi_a (1) \psi_b (2) - \psi_a (2) \psi_b (1) ] $
Ak sa pozrieme bližšie na hore uvedenú symetrickú vlnovú funkciu $ \psi_S $ zistíme, že opisuje súbor dvoch bozónov (celočíselný spin). Umožňuje totiž, aby sa v jednom stave (a=b) nachádzali obidva bozóny. Naopak vlnové funkcia $ \psi_A $ opisuje súbor dvoch fermiónov (poločíselný spin) a vyjadruje (experimentálne overenú) skutočnosť, že pravdepodobnosť nájdenia dvoch fermiónov v rovnakom stave (a=b) je nulová. Inými slovami vlnová funkcia $ \psi_A $ je matematickým vyjadrením Pauliho vylučovacieho princípu pre dva fermióny.
Pre zaujímavosť, v prípade viacfermiónového systému je celkový stav popísaný nasledujúcim výrazom (je to zápis pomocou slaterovho determinantu):
- $ \Psi(\mathbf{x}_1, \mathbf{x}_2, \ldots, \mathbf{x}_N) = \frac{1}{\sqrt{N!}} \left| \begin{matrix} \chi_1(\mathbf{x}_1) & \chi_2(\mathbf{x}_1) & \cdots & \chi_N(\mathbf{x}_1) \\ \chi_1(\mathbf{x}_2) & \chi_2(\mathbf{x}_2) & \cdots & \chi_N(\mathbf{x}_2) \\ \vdots & \vdots && \vdots \\ \chi_1(\mathbf{x}_N) & \chi_2(\mathbf{x}_N) & \cdots & \chi_N(\mathbf{x}_N) \end{matrix} \right|. $
Tento výraz používa tzv. súradnicovú reprezentáciu, index pri priestorovej premennej $ \mathbf{x} $ označuje polohu danej častice a index pri vlnových funkciách $ \chi $ označuje jeden z n možných stavov. Z tohto determinantu je okamžite vidieť, že takáto vlnová funkcia je antisymetrická. Napríklad výmenou prvého riadku za druhý zameníme časticu 1 za časticu 2, ale súčasne zmeníme znamienko determinantu.
Slovne teda môžeme vyjadriť Pauliho vylučovací princíp následovne. V systéme častíc s poločíselným spinom sa realizujú jedine antisymetrické stavy, dva fermióny sa nemôžu nachádzať v rovnakom kvantovom stave.
Skladanie orbitálneho momentu hybnosti a spinu[editovat | editovat zdroj]
V klasickej mechanike prebiehalo skladanie momentov hybnosti pomerne jednoducho, jednalo sa o ich vektorové sčítanie. V kvantovej mechanike však moment hybnosti nie je vektor (ale spinor) a preto nebudeme očakávať, že budú platiť tie isté pravidlá. Taktiež sa musíme vysporiadať s novým druhom momentu hybnosti a to spinom.
Pozrime sa teraz na to, ako sa zloží orbitálny moment hybnosti $ l $ nejakej častice s jej spinom $ s $. Obe spomínané veličiny sú kvantované. Výsledný moment hybnosti $ j $ zložený z orbitálneho momentu hybnosti $ l $ a spinu $ s $ musí byť taktiež kvantovaný. Celkovo musia preto platiť tieto kvantovacie podmienky:
- $ \, J^2 |s,m\rangle = \hbar^2 j(j + 1) |j,m_j\rangle $
- $ \, J_z |s,m\rangle = \hbar m_j |j,m_j\rangle $
- $ \, L^2 |s,m\rangle = \hbar^2 l(l + 1) |l,m_l\rangle $
- $ \, L_z |s,m\rangle = \hbar m_l |l,m_l\rangle $
- $ \, S^2 |s,m\rangle = \hbar^2 s(s + 1) |s,m_s\rangle $
- $ \, S_z |s,m\rangle = \hbar m_s |s,m_s\rangle $
- $ \, J^2 |s,m\rangle = \hbar^2 j(j + 1) |j,m_j\rangle $
Tieto podmienky sú presne to čo odlišuje skladanie momentu hybnosti v kvantovej mechanike od skladania momentu hybnosti v klasickej mechanike. Ak chceme splniť tieto dodatočné podmienky, potom sa musíme obmedziť na určité možné hodnoty $ j $. Výsledny moment hybnosti $ j $ zložený z orb. momentu hybnosti $ l $ a spinu $ s $ môže nadobúdať len tieto hodnoty:
- $ | l - s | \le j \le | l + s | $ $ j $ musí byť celočíselné
- $ | l - s | \le j \le | l + s | $ $ j $ musí byť celočíselné
Predveďme si to na konkrétnom prípade. Máme časticu s orbit8lnym momentom hybnosti $ \, l= 2 $ a spinom $ \, s = 1 $. Vrchná podmienka nám hovorí, že $ j $ môže nadobúdať hodnoty $ 1, \, 2 $ a $ \, 3 $. To isté pravidlo platí aj pre skladanie dvoch orbitálnych momentov hybnosti, či prípadne pre skladanie dvoch spinov.
Otázka projekcie výsledného momentu hybnosti $ J $ na (povedzme) os z je pomerne komplikovanou záležitosťou a súvisí s takzvanými Clebsch-Gordanovými koeficientmi.
Kvantovo mechanický popis atómu[editovat | editovat zdroj]
Elektrónová konfigurácia[editovat | editovat zdroj]
Atóm každého prvku by sa dal stručne popísať ako pozostávajúci z kladne nabitého jadra a elektrónového obalu. Je jasné, že elektromagnetické interakcie nie su obmedzené iba na interakcie medzi elektrónmy a protónmy, ale že aj elektróny medzi sebou navzájom interagujú.
Obraz o fyzike mnohoelektrónových atómov sa však dá spraviť pomocou priblíženia, ktorému sa často hovorí jedno elektrónová alebo aj Hartreeho aproximácia. Priblíženie spočíva v predpoklade, že elektróny sa pohybujú pod vplyvom elektromagnetického poľa jadra a akéhosi spriemerovaného stredného elektrónového poľa. Rátanie prebieha následovnym algoritmom:
0. krok Riešením mnohoelektrónového atómu nech je istá funkcia $ \psi $. Budeme o nej jednoducho predpokladať, že sa dá zapísať ako súčin jednotlivých funkcií $ \psi_i $, ktoré popisujú správanie sa i-tého elektrónu. Tento predpoklad nesplňuje samozrejme Pauliho vylučovací princíp, podľa ktorého vlnová funkcia popisujúca fermióny musí byť antisymetrická. S takto ohadnutým riešením pristupujeme k prvému kroku.
1. krok K jednotlivým elektrónom pristupujeme ako k záporne nabitým oblakom. Priestorové rozloženie náboja i-tého elektrónu $ \rho_i \,(x_i,y_i,z_i) $ sa riadi vlnovou funkciou $ \psi_i $ podľa vzťahu:
- $ \rho_i = \int |\psi_i \, (x_i,y_i,z_i)|^2 \,dx $
- $ \rho_i = \int |\psi_i \, (x_i,y_i,z_i)|^2 \,dx $
Pričom premennými $ x_i $ ,$ y_i $ a $ z_i $ sme označili polohu i-teho elektrónu v atóme. Spriemerované pole elektrónov bude potom súčtom polí od jednotlivých elektrónových oblakov. Postupujme ďalej k druhému kroku.
2. krok Riešime stacionárnu Schroedingerovú rovnicu pre každý a jeden i-tý elektrón, pričom celkové pole je dané súčtom poľa jadra a spriemerovaného elektrónového poľa. Tieto rovnice nazývame Hartreeho rovnicami a ich riešením budú nové funkcie $ \psi_i $ . Celková vlnová funkcia bude opäť súčinom $ \psi_i $ a môžeme prejsť k prvému kroku algoritmu. Algoritmus prechádzame dovtedy, kým nie sme s výsledkom spokojný (napríklad nové funkcie $ \psi_i $ sa líšia od starých len nepatrne).
Najväčším nedostatkom Haartreho algoritmu je predpoklad o možnosti zapísať celkovú vlnovú funkciu ako súčin jednotlivých stavov elektrónov. Takáto funkcia samozrejme nesplňuje Pauliho vylučovací princíp, podľa ktorého vlnová funkcia popisujúca fermióny musí byť antisymetrická. Je totiž evidentné, že výmena i-tého elektrónu za j-tý elektrón by taktúto funkciu nezmenila.
Tento nedostatok rieši až Hartree-Focková aproximácia, jej podrobnosti nájdete na Javorského slide. Stručne povedané Hartree-Focková aproximácia od začiatku predpokladá antisymetrickú vlnovú funkciu ako riešenie a modifikuje Haartreho rovnice o člen ktorý sa dá interpretovať ako výmennný člen medzi jednotlivými elektrónmi (Hartree-Fock teda zarátava aj interakcie medzi jednotlivými elektrónmi).
Elektrické a magnetické momenty[editovat | editovat zdroj]
Elektrické momenty[editovat | editovat zdroj]
Molekuly niektorých látok vôbec nemajú dipólový moment: ten vzniká až pôsobením elektrického poľa - to sú nepolárne látky. Iné látky obsahujú stále elektrické dipóly, normálne náhodne orientované, takže sa ich moment vyruší. Až vonkajšie elektrické pole ich trochu zorientuje a spôsobí výslednú polarizáciu.
Příkladem polárních látek jsou - voda, anorganické kyseliny, nižší alkoholy (methanol, ethanol, propanol, butanol a některé další) a kyselina mravenčí. Nepolární rozpouštědla jsou například benzen, tetrachlormethan a diethylether.
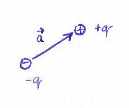
Elektrický dipól, vytvorený dvoma nábojmi $ +q $ a $ -q $ je definovaný ako
$ \mathbf{p} = |q|. \mathbf{a} $
kde $ \mathbf{a} $ smeruje ku kladnému náboju.
V kvantovej teórii je dipólový moment operátor pôsobiaci na vlnovú funkciu: ak je $ {\psi_i} $ báza Hilbertovho priestoru stavov nejakej atómovej sústavy, má v tejto báze dipólový moment maticu
$ \mathbf{\hat{p}}_{ij} = \langle \psi_i | \mathbf{\hat{p}} | \psi_j | \rangle $ A co je $ \mathbf{\hat{p}} $?
V prípade jednoduchej vlnovej funkcie jednej častice s nábojom q je
$ \mathbf{\hat{p}}_{ij} = \int_V \psi_i^* q\mathbf{r} \psi_j dV $ Je $ \mathbf{r} $ polohovým vektorem? Tzn pokud $ dV=dx dy dz $, je $ \mathbf{r}=(x, y, z) $?
Maticový element $ p_{ij} $ sa volá prechodový dipólový moment a jeho nenulovosť je nutnou podmienkou prechodu medzi hladinami i, j vyvolanému elektrickým poľom elmag. vlny.
Magnetické momenty[editovat | editovat zdroj]
Klasický model magnetického momentu[editovat | editovat zdroj]
Predstavme si časticu hmotnosti $ m $ a elektrického náboja $ q $ krúžiacu po kružnici polomeru $ r $ rýchlosťou $ v $. Taká častica má orbitálny moment hybnosti veľkosti
$ L = m v r $
a vytvára elektrický prúd
$ I = \frac{\Delta q}{\Delta t} = \frac{q}{\frac{2\pi r}{v}} = \frac{qv}{2\pi r} $
obiehajúci plochu $ S = \pi r^2 $. Z definície je potom veľkosť magnetického momentu
$ \mu = IS = \frac{qvr}{2} = \frac{q\cdot mvr}{2m} = \frac{q}{2m} L $
a teda vektor magnetického momentu
$ \boldsymbol{\mu} = \frac{q}{2m} \mathbf{L} $
Všimnite si, že pre elektrón, ktorého náboj je záporný $ q_e=-e $, je magnetický moment orientovaný opačne než moment hybnosti. To platí pre orbitálny aj pre spinový moment hybnosti.
Vidíme teda, že magnetický moment je úmerný momentu hybnosti. Tento poznatok je kľúčový a platí vždy, aj v kvantovke. Pomer magnetického momentu $ \mu $ a momentu hybnosti $ L $ sa nazýva gyromagnetický pomer a pre orbitálny moment hybnosti je, ako sme zistili, rovný
$ \gamma = \frac{q}{2m} $
Kvantový model[editovat | editovat zdroj]
V skutočnosti však v mikrosvete pre atómy a molekuly tento klasický vzťah neplatí, rôzne momenty hybnosti môžu prispievať rôzne k celkovému magnetickému momentu. Napríklad príspevok k magnetickému momentu elektrónu od spinového momentu hybnosti je dvakrát väčší, než by sa čakal na základe klasického vzťahu. Aby toto zohľadnil, zaviedol Landé tzv. g-faktor; magnetický moment od nejakého všeobecného momentu hybnosti $ J $ potom je
$ \mu = g \cdot \frac{q}{2m} J $
kde q, m sú náboj a hmotnosť častice(pre atómové jadrá a iné ťažké častice, ako napr. neutrón, ktoré majú rôzne náboje a hmotnosti, sa však Landého vzťah systematicky používa s nábojom a hmotnosťou protónu, aby v tom bol poriadok). Pre orbitálny pohyb elektrónu je $ g_o = 1 $, pre spin elektrónu $ g_{s} = 2 $. Teraz pozor, tu býva trochu zmätok. Orbitálny moment hybnosti častíc sa kvantuje po jednotkách $ \hbar $ a platí preň $ g=1 $, spinový moment hybnosti sa kvantuje po $ \frac{\hbar}{2} $, ale preň je zase g = 2, takže orbitálny aj spinový moment hybnosti dajú rovnaké príspevky k magnetickému momentu. Tento príspevok sa vola Bohrov magnetón a jeho hodnota je
$ \mu_B = \frac{e}{2m}\hbar \approx 9,274.10^{-24}\mathrm{JT^{-1}} $
Nejaký čas sa počítalo s g=2, no v štandardnej kvantovke to bol navyše zavedený poznatok. Z teórie ho vytiahol až Dirac, kedy dostal pre g-faktor spinového momentu presne 2. O niečo neskôr presné merania ukázali, že v skutočnosti je Landého faktor elektrónu trochu väčší než 2, konkrétne 2.(1,0011) kvôli interakcii s vákuom, čo vysvetlil prvý Schwinger výpočtom z kvantovej elektrodynamiky.
Ako je to s magnetickými momentami nukleónov a jadier? Tu platí obdobný vzťah, ale používa sa náboj a hmotnosť protónu(typická hmotnosť):
$ \mu = g \cdot \frac{e}{2m_p} J $
Landého faktor pre spin protónu sa ale líši od elektrónového, totiž je g = 2.(2,79) a pre neutrón, ktorý vôbec nemá elektrický náboj, je g = 2.(-1,93), chová sa teda ako rotujúci záporný náboj.
Magnetický moment molekuly je daný súčtom všetkých magnetických momentov od všetkých elektrónov - tu treba správne zložiť všetky momenty hybnosti a príslušné magnetické momenty.
Literatúra[editovat | editovat zdroj]
Beiser Kapitoly: 5. Struktura atomu, 6. Bohrův model atomu, 10. Mnohaelektronové atomy,